acide : (remarque : une autre conception des acides sera présentée en classe de 1ère)
Un acide est un composé moléculaire renfermant l'élément hydrogène («hydrogène acide») lié à un reste d'acide (R) qui peut être un non-métal ou un groupement (différent du groupement ammonium) ; la formule générale d'un acide est ainsi : HnR.
La dissolution dans l'eau d'un acide s'accompagne toujours d'une dissociation en ions avec libération d'un ou plusieurs cations H+ (protons).
Selon la nature du reste d'acide, on fait la distinction entre hydracides, oxacides et acides carboxyliques.
Pour les noms et les formules des hydracides et des oxacides, consulter la marche à suivre correspondante.
Selon le nombre d'atomes d'«hydrogène acide», on fait la distinction entre monoacides (1 H «acide»), diacides (2 H «acides») et triacides (3 H «acides»).
Selon le degré de dissociation ionique, on fait la distinction entre acides forts et acides faibles.
acide (solution) :
Une solution acide présente un excès d'ions H+. Le pH d'une solution acide se situe entre 0 et 7 : plus l'acidité de la solution est grande, plus la valeur du pH est basse.
acide carboxylique :
Les acides carboxyliques sont des acides organiques qui renferment tous le groupement 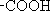 , dont l'atome d'hydrogène représente l'«hydrogène acide».
, dont l'atome d'hydrogène représente l'«hydrogène acide».
Selon le nombre de groupements 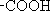 , un acide carboxylique peut être un monoacide, diacide, triacide, ...
, un acide carboxylique peut être un monoacide, diacide, triacide, ...
acide faible :
Pour un acide faible la dissociation en ions des molécules en solution aqueuse n'est que partielle : une très grande partie des molécules d'acide se retrouve en solution sous forme de molécules.
acide fort :
Pour un acide fort la dissociation en ions des molécules en solution aqueuse est quasi totale.
acide minéral :
Les hydracides et les oxacides sont des acides minéraux. Les atomes d'«hydrogène acide» sont liés à un non-métal ou à un groupement non-métallique et n'appartiennent pas à un groupement 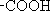 .
.
acide organique :
Les acides carboxyliques sont des acides organiques. Les atomes d'«hydrogène acide» appartiennent à un groupement 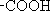 .
.
base : (remarque : une autre conception des bases sera présentée en classe de 1ère)
Une base (hydroxyde) est un composé ionique renfermant l'anion hydroxyde OH- associé à un cation métallique ou au groupement ammonium : la formule générale d'une base est ainsi 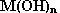 .
.
En solution aqueuse, un hydroxyde soluble dans l'eau se sépare en ions libres.
Selon le nombre d'anions OH- par unité de formule, on fait la distinction entre monobases (1 anion OH-), dibases (2 anions OH-) et tribases (3 anions OH-).
basique (solution) :
Une solution basique présente un excès d'ions OH-. Le pH d'une solution basique se situe entre 7 et 14 : plus la basicité de la solution est grande, plus la valeur du pH est élevée.
équation ionique :
Dans une équation ionique, on écrit pour les composés ioniques et pour les molécules d'acide dissociées en ions en solution aqueuse, les différents ions et non pas la formule globale du composé.
Pour les composés moléculaires non dissociés en ions on écrit la formule moléculaire.
Pour plus de détails, consulter la marche à suivre correspondante.
équation ionique simplifiée :
L'équation ionique simplifiée s'obtient à partir de l'équation ionique en supprimant les ions spectateurs. Elle ne contient que les corps et ions transformés au cours de la réaction.
Pour plus de détails, consulter la marche à suivre correspondante.
hydracide :
Les hydracides sont des acides minéraux ne renfermant pas l'élément oxygène : le reste d'acide est un élément non-métallique ou un groupement non oxygéné.
Le nom des hydracides commence par acide suivi du nom de l'anion correspondant au reste d'acide dans lequel la terminaison «-ure» est remplacée par «-hydrique».
«hydrogène acide» :
Les molécules d'acide renferment toutes l'élément hydrogène lié à un reste d'acide : ces atomes d'hydrogène, qui en solution aqueuse peuvent quitter la molécule sous forme d'ions H+ sont appelés «hydrogènes acides».
Remarque : Les acides carboxyliques renferment beaucoup d'atomes d'hydrogène appartenant au reste d'acide qui ne forment pas d'ions en solution aqueuse mais restent liés par liaison covalente à la chaîne carbonée du reste d'acide : pour les acides organiques, seuls les atomes d'hydrogène des groupements 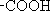 sont des «hydrogènes acides».
sont des «hydrogènes acides».
hydroxyde :
Un hydroxyde est un composé ionique renfermant l'ion OH-. La dissolution dans l'eau des hydroxydes solubles produit des solutions basiques.
indicateur coloré acide-base :
Substance organique dont la couleur change avec le caractère acide ou basique du milieu. (le changement de couleur résulte d'une modification dans la structure de la molécule de colorant)
 | Un exemple d'un indicateur coloré acide-base est la phénolphthaléine qui est incolore en milieu acide ainsi qu'en milieu neutre et qui prend une teinte rouge-rose en milieu basique. |  |
ions spectateurs :
Les ions spectateurs sont les ions qui, au cours de la réaction, ne subissent pas de transformation.
métal noble :
Les métaux nobles résistent à l'attaque des ions H+ cédés par les acides. Exemples de métaux nobles : argent, or, platine, ...
métal non noble :
Les métaux non nobles sont attaqués par les acides avec dégagement de dihydrogène gazeux et formation d'un sel. Exemples de métaux non nobles : magnésium, zinc, fer, ...
Pour plus de détails, consulter la marche à suivre correspondante.
neutralisation :
Une neutralisation est une réaction entre un acide et une base au cours de laquelle se forment un sel et de l'eau. Les ions qui subissent une transformation au cours d'une telle réaction sont les cations H+ provenant de l'acide et les anions OH- provenant de la base, qui réagissent pour former de l'eau.
Pour plus de détails, consulter la marche à suivre correspondante.
neutre (solution) :
Une solution neutre ne présente ni un excès d'ions H+, ni un excès d'ions OH-. Le pH d'une solution neutre est 7.
oxacide ou oxoacide :
Les oxacides sont des acides minéraux renfermant l'élément oxygène : le reste d'acide est un groupement oxygéné.
Le nom des oxacides commence par acide suivi du nom de l'anion correspondant au reste d'acide dans lequel la terminaison «-ate» est remplacée par «-ique», la terminaison «-ite» par «-eux».
pH :
Le pH (potentia Hydrogenii ou potentiel d'hydrogène) est une grandeur numérique caractérisant l'acidité ou la basicité d'une solution aqueuse.
Le pH correspond mathématiquement à l'opposé du logarithme décimal de la concentration molaire en ions H+ ([H+] en mol/L) dans la solution : pH = -log[H+] ou [H+]=10-pH. Ainsi p.ex. une multiplication de la concentration en ions H+ par le facteur 10, entraîne une diminution d'une unité sur l'échelle de pH.
L'échelle de pH s'étend de 0 à 14 :
0 ≤ pH < 7 : | | domaine acide
|
|
| | plus l'acide est fort, plus la dissociation en ions est importante, plus la concentration en ions H+est grande et plus le pH est faible |
|
|
pH = 7 : | | domaine neutre
|
|
|
7 < pH ≤ 14 : | | domaine basique
|
|
| | plus la base est forte, plus la dissociation en ions est importante, plus la concentration en ions OH-est grande et plus le pH est élevé |
proton :
Un ion H+ se forme à partir d'un atome d'hydrogène (1 p+, 1 e-, 0 n0) par perte d'un électron : le cation H+ (1 p+, 0 e-, 0 n0) correspond donc à un proton.
reste d'acide :
Les molécules d'acide renferment toutes un ou plusieurs atomes d'«hydrogène acide» liés à un reste d'acide : le reste d'acide peut être un non-métal ou un groupement non oxygéné dans le cas d'un hydracide et un groupement oxygéné dans le cas d'un oxacide. Dans le cas d'un acide carboxylique, le reste d'acide comprend la chaîne carbonée ainsi que la partie COO du groupement caractéristique des acides carboxyliques.
sel :
Les sels sont des composés ioniques constitués pour la plupart d'un cation métallique et d'un anion non-métallique (il peut s'agir d'un groupement non-métallique chargé). Les sels forment des réseaux ioniques : comme le nombre d'ions dans le réseau ionique n'est pas déterminé, la formule ionique n'indique que le rapport des différents ions dans le composé.
, dont l'atome d'hydrogène représente l'«hydrogène acide».
, un acide carboxylique peut être un monoacide, diacide, triacide, ...
.
.
.
sont des «hydrogènes acides».

