quitter les
mots-clés
A B C D E F G H I L M N O P Q R S T U V
acide : (remarque : une autre conception des acides sera présentée en classe de 1ère)Un acide est un composé moléculaire renfermant l'élément hydrogène («hydrogène acide») lié à un reste d'acide (R) qui peut être un non-métal ou un groupement (différent du groupement ammonium) ; la formule générale d'un acide est ainsi : HnR.
La dissolution dans l'eau d'un acide s'accompagne toujours d'une dissociation en ions avec libération d'un ou plusieurs cations H+ (protons).
Selon la nature du reste d'acide, on fait la distinction entre hydracides, oxacides et acides carboxyliques.
Pour les noms et les formules des hydracides et des oxacides, consulter la marche à suivre correspondante.
Selon le nombre d'atomes d'«hydrogène acide», on fait la distinction entre monoacides (1 H «acide»), diacides (2 H «acides») et triacides (3 H «acides»).
Selon le degré de dissociation ionique, on fait la distinction entre acides forts et acides faibles.
acide (solution) :Une solution acide présente un excès d'ions H+. Le pH d'une solution acide se situe entre 0 et 7 : plus l'acidité de la solution est grande, plus la valeur du pH est basse.
acide carboxylique :Les acides carboxyliques sont des acides organiques qui renferment tous le groupement, dont l'atome d'hydrogène représente l'«hydrogène acide».
Selon le nombre de groupements, un acide carboxylique peut être un monoacide, diacide, triacide, ...
acide faible :Pour un acide faible la dissociation en ions des molécules en solution aqueuse n'est que partielle : une très grande partie des molécules d'acide se retrouve en solution sous forme de molécules.
acide fort :Pour un acide fort la dissociation en ions des molécules en solution aqueuse est quasi totale.
acide minéral :Les hydracides et les oxacides sont des acides minéraux. Les atomes d'«hydrogène acide» sont liés à un non-métal ou à un groupement non-métallique et n'appartiennent pas à un groupement.
acide organique :Les acides carboxyliques sont des acides organiques. Les atomes d'«hydrogène acide» appartiennent à un groupement.
acier :L'acier est un alliage de fer et de carbone avec une teneur en carbone inférieure à 1,7 % en masse.
addition (réaction d'):Au cours d'une réaction d'addition, une liaison multiple se simplifie par fixation d'atomes (ou de groupements d'atomes) supplémentaires.
L'addition d'un halogène sur un alcène ou un alcyne est l'exemple d'une réaction d'addition : des atomes d'halogène se lient aux atomes de carbone des liaisons multiples en utilisant les électrons engagés dans les liaisons multiples : celles-ci se simplifient.
alcane :Un alcane est un hydrocarbure saturé aliphatique dont la chaîne carbonée peut être linéaire (n-alcanes) ou ramifiée.
Sa formule générale est de la forme : CnH2n+2.
Les noms des alcanes ont tous la terminaison -ane. Ils dérivent des noms de la série homologue des n-alcanes.
alcène :Un alcène est un hydrocarbure insaturé aliphatique dont la chaîne carbonée comporte une ou plusieurs liaisons doubles.
Les noms des alcènes ont tous la terminaison -ène. Ils dérivent des noms de la série homologue des n-alcanes.
alcyne :Un alcyne est un hydrocarbure insaturé aliphatique dont la chaîne carbonée comporte une ou plusieurs liaisons triples.
Les noms des alcynes ont tous la terminaison -yne. Ils dérivent des noms de la série homologue des n-alcanes.
aliphatique :Un hydrocarbure est aliphatique, si sa chaîne carbonée est ouverte, ce qui signifie qu'elle n'est pas fermée sur elle-même pour former un cycle (acyclique).
alkyle (groupement):On appelle groupement alkyle un groupement dérivé d'un alcane.
p.ex. le groupement méthyle CH3- dérivé du méthane CH4
anion :Ion de charge négative. Il renferme plus d'électrons que de protons.
atome :L'atome est une entité électriquement neutre composée d'un noyau et d'un cortège électronique.base : (remarque : une autre conception des bases sera présentée en classe de 1ère)Une base (hydroxyde) est un composé ionique renfermant l'anion hydroxyde OH- associé à un cation métallique ou au groupement ammonium : la formule générale d'une base est ainsi.
En solution aqueuse, un hydroxyde soluble dans l'eau se sépare en ions libres.
Selon le nombre d'anions OH- par unité de formule, on fait la distinction entre monobases (1 anion OH-), dibases (2 anions OH-) et tribases (3 anions OH-).
basique (solution) :Une solution basique présente un excès d'ions OH-. Le pH d'une solution basique se situe entre 7 et 14 : plus la basicité de la solution est grande, plus la valeur du pH est élevée.catalyseur :Un catalyseur est une substance utilisée pour augmenter la vitesse d'une réaction chimique. Le catalyseur n'est pas consommé au cours de la réaction ; au terme de la réaction, il peut être récupéré.
cation :Ion de charge positive. Il renferme plus de protons que d'électrons.
chaîne carbonée :Une chaîne carbonée est un enchaînement par liaisons covalentes d'atomes de carbone constituant le squelette des molécules organiques.
chimie inorganique ou minérale :La chimie inorganique est la chimie de tous les composés qui ne sont pas attribués à la chimie organique.
Pour plus de détails, consulter la marche à suivre permettant de distinguer corps organiques et inorganiques.
chimie organique :La chimie organique est la chimie des composés du carbone.
Pour plus de détails concernant aussi des composés du carbone attribués à la chimie inorganique, consulter la marche à suivre permettant de distinguer corps organiques et inorganiques.
classification périodique :Tableau des éléments chimiques disposés en lignes (appelées périodes) et en colonnes (appelées groupes ou familles). Ces dernières regroupent des éléments dont les propriétés chimiques présentent des analogies. Le premier tableau périodique fut imaginé par Mendeleev en 1869.
(voir aussi le tableau périodique ou le tableau périodique ONLINE)
c.n.t.p. :conditions normales de température et de pression (T=0°C et p=1,013.105 Pa)
coefficients stoechiométriques :Les coefficients stoechiométriques sont les chiffres placés devant les symboles ou les formules dans une équation chimique et qui permettent d'équilibrer l'équation : ils indiquent donc la proportion dans laquelle les corps réagissent ou sont formés.
comburant :Corps qui entretient ou renforce la combustion d'un corps combustible.
combustible :Corps qui a la propriété de brûler.
combustion :Une combustion est une réaction entre un corps combustible et le dioxygène, qui ne sont pas mélangés dès le départ, mais au cours de laquelle le dioxygène doit accéder à la flamme à partir du milieu ambiant (le plus souvent l'air).
Ainsi une combustion est beaucoup moins rapide et moins violente que l'explosion d'un mélange du même corps avec le dioxygène.
combustion / oxydation complète :Une oxydation est complète, si l'apport en dioxygène est suffisant : les produits de la combustion complète d'un hydrocarbure sont du dioxyde de carbone et de l'eau.
On voit qu'une combustion est complète au fait que la flamme ne présente pas de brillance.
L'explosion d'un mélange d'un hydrocarbure avec le dioxygène (ou l'air) correspond toujours à une oxydation complète.
combustion / oxydation incomplète :Une oxydation est incomplète, si l'apport en dioxygène est insuffisant : les produits de la combustion incomplète d'un hydrocarbure sont du carbone et de l'eau.
On voit qu'une combustion est incomplète à la brillance de la flamme qui provient des particules de carbone chauffées à incandescence.
composé ionique :Un composé ionique est formé d'ions liés par liaison ionique - il est constitué par un métal ou le groupement ammonium associé à un non-métal ou à un groupement non-métallique différent du groupement ammonium.composé moléculaire :
Un composé moléculaire est formé d'atomes liés par liaison covalente - il est constitué par des non-métaux.composé inorganique ou minéral :
Les corps inorganiques sont les composés qui ne sont pas attribués à la chimie organique.
Pour plus de détails, consulter la marche à suivre permettant de distinguer corps organiques et inorganiques.
composé organique :Les corps organiques sont les composés du carbone : ils renferment toujours l'élément carbone associé presque toujours à l'hydrogène, et souvent aussi à l'oxygène, à l'azote, à un halogène, au soufre, ...
Pour plus de détails concernant aussi des composés du carbone attribués à la chimie inorganique, consulter la marche à suivre permettant de distinguer corps organiques et inorganiques.
concentration :La concentration (c) en soluté d'une solution, exprimée en g/L ou en mol/L, représente la quantité de soluté dissoute dans un 1 L de solution.
Si la quantité de soluté est exprimée en masse, on parle de concentration massique, si elle l'est en quantité de matière, on parle de concentration molaire.
concentration massique :La concentration massique (b), exprimée en g/L correspond au rapport de la masse (en g) du soluté par rapport au volume de la solution (en L) :
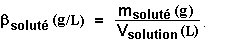
concentration molaire ou molarité :La concentration molaire (c), exprimée en mol/L (unité souvent notée M) correspond au rapport de la quantité de matière (en mol) du soluté par rapport au volume de la solution (en L) :
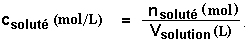
configuration électronique :La configuration électronique d'un atome décrit la répartition de ses électrons dans les différentes couches électroniques autour du noyau.
Pour décrire la configuration électronique on utilise une notation dans laquelle on fait figurer en exposant, à côté de la lettre caractérisant la couche (écrite entre parenthèses), le nombre d'électrons sur cette couche.
p.ex. (K)2(L)4 pour la configuration électronique de l'atome de carbone.
corps composé :Il s'agit d'un corps constitué d'atomes d'au moins deux éléments différents.
cortège électronique :Le cortège électronique est constitué par les électrons circulant autour du noyau atomique.
couche de valence :La couche de valence est la dernière couche électronique sur laquelle, pour l'atome en question, se trouvent encore des électrons.
Pour les éléments des familles principales (familles I à VIII), les éléments d'une même famille du TPE ont le même nombre d'électrons sur leur couche de valence : on parle des électrons de valence.
couche électronique :Selon le modèle de Bohr, les électrons sont répartis autour du noyau, sur différentes couches électroniques à des distances différentes du noyau.
Chaque couche correspond à un niveau d'énergie déterminé. Les couches sont caractérisées par un numéro (n =1,2,3,4, ...) ou par une lettre (K,L,M,N,...) et ne peuvent contenir qu'un nombre limité d'électrons : le nombre maximal d'électrons pour chaque couche correspond à 2 n2 où n est le numéro de la couche.
(remarque : il est logique que, plus une couche est éloignée du noyau, plus elle est grande et plus elle peut par conséquent comporter d'électrons)
cyclane :Un cyclane est un hydrocarbure saturé cyclique dont la chaîne carbonée fermée sur elle-même peut porter des ramifications aliphatiques.
Sa formule générale est de la forme : CnH2n.
Les noms des cyclanes ont tous le préfixe -cyclo et la terminaison -ane. Ils dérivent des noms de la série homologue des n-alcanes.
cyclène :Un cyclène est un hydrocarbure insaturé cyclique dont le cycle comporte une ou plusieurs liaisons doubles.
Les noms des alcènes ont tous le préfixe cyclo- et la terminaison -ène. Ils dérivent des noms de la série homologue des n-alcanes.
cyclique :Un hydrocarbure est cyclique, si sa chaîne carbonée est fermée sur elle-même pour former un cycle.densité :La densité (d) d'un corps, exprimée par un nombre sans unité, est le rapport entre la masse d'un certain volume de ce corps et la masse du même volume d'un corps de référence. Pour les gaz le corps de référence est l'air.
La densité d'un corps gazeux par rapport à l'air est le rapport entre la masse d'un volume donné de ce gaz et la masse du même volume d'air pris dans les mêmes conditions de température et de pression :
dilution :Diluer une solution correspond à ajouter un liquide à cette solution pour diminuer sa concentration en soluté.
doublet de liaison :Le doublet de liaison est une paire d'électrons formée par la mise en commun entre deux atomes de deux électrons de leurs couches de valence - une telle mise en commun donne lieu à une liaison covalente. Le doublet de liaison, mis en commun entre les deux atomes, est considéré comme appartenant à chacun des deux atomes liés.
doublet électronique :2 électrons d'une couche électronique regroupés en paire.
doublet libre :Le doublet libre est une paire d'électrons de valence qui n'est pas mise en commun.électrolyte :Un électrolyte est un corps dont la solution aqueuse est conductrice du courant électrique, c.-à-d. contient des ions.
électron (e-) :L'électron est la particule élémentaire chargée négativement.
Sa charge est de -1,6 10-19 C : il s'agit de la charge élémentaire négative -1.
La masse de l'électron est négligeable par rapport à celle des nucléons.
Les électrons évoluent autour du noyau atomique.
électron célibataire :Électron qui ne fait pas partie d'un doublet électronique.
électron de valence :Électron qui se trouve sur la couche de valence.
Les électrons de valence jouent un rôle prépondérant dans l'établissement de liaisons chimiques entre atomes et déterminent ainsi en majeure partie les propriétés chimiques d'un élément.
Pour les éléments des familles principales (familles I à VIII), les éléments d'une même famille du TPE ont le même nombre d'électrons de valence.
élément chimique :Ensemble des particules (atomes ou ions) qui ont le même nombre de protons dans le noyau (même numéro atomique Z).
élément de transition :Les éléments de transition sont les éléments situés dans la partie centrale du tableau périodique des éléments : voir le détail dans le tableau périodique.
équation chimique :Une équation chimique permet de résumer une réaction chimique, en tenant compte du fait que les réactifs deviennent des produits et de la loi de la conservation de la masse.
équation ionique :Dans une équation ionique, on écrit pour les composés ioniques et pour les molécules d'acide dissociées en ions en solution aqueuse, les différents ions et non pas la formule globale du composé.
Pour les composés moléculaires non dissociés en ions on écrit la formule moléculaire.
Pour plus de détails, consulter la marche à suivre correspondante.
équation ionique simplifiée :L'équation ionique simplifiée s'obtient à partir de l'équation ionique en supprimant les ions spectateurs. Elle ne contient que les corps et ions transformés au cours de la réaction.
Pour plus de détails, consulter la marche à suivre correspondante.
équilibrer une équation :Équilibrer une équation chimique sert à avoir le même nombre d'atomes de chaque sorte dans les deux membres de l'équation. Pour équilibrer une équation on place des coefficients stoechiométriques devant la formule des corps. Il est strictement défendu de modifier les indices figurant dans les formules chimiques.
états d'agrégation :Les états d'agrégation dans lesquels se trouvent les substances chimiques sont souvent indiqués dans les équations chimiques, entre parenthèses en bas à droite du symbole ou de la formule du corps :solide : (s)
liquide : (l)
gazeux : (g)
en solution dans l'eau : (aq)
explosion :Une explosion est une réaction pour laquelle les réactifs sont mélangés dès le départ et optimalement (pour produire l'explosion la plus violente) dans les proportions stoechiométriques.
L'explosion d'un mélange d'un combustible avec le dioxygène est ainsi beaucoup plus rapide et violente (dilatation brutale des gaz) que la combustion du même corps.famille ou groupe d'éléments :Les éléments appartenant à une même famille ont des propriétés chimiques analogues ce qui est dû au fait qu'ils ont le même nombre d'électrons de valence. On retrouve les éléments d'un famille dans une colonne du tableau périodique des éléments.
formule brute :La formule brute renseigne sur la nature et le nombre des atomes qui composent une molécule.
Des indices placés en bas à droite des symboles et groupes d'atomes indiquent la fréquence avec laquelle ils interviennent.
formule chimique :La formule chimique est l'écriture symbolique qui décrit la composition atomique d'un corps : des indices sont placés en bas à droite des symboles et groupements pour indiquer la fréquence avec laquelle ils interviennent.
On fait la distinction entre formules moléculaires et formules ioniques.
formule de Lewis :La formule de Lewis d'une molécule s'écrit à partir des symboles de Lewis : elle fait apparaître tous les atomes de la molécule ainsi que tous les doublets de liaison et tous les doublets libres.
formule développée :La formule développée renseigne sur l'enchaînement des atomes qui composent une molécule - les symboles de tous les atomes ainsi que toutes les liaisons sont indiqués.
Pour plus de détails, consulter la marche à suivre correspondante.
formule en bâtonnets ou représentation stylisée :La formule en bâtonnets est une simplification de la formule semi-développée : on n'écrit pas les symboles des atomes de carbone et d'hydrogène (liés à un atome de carbone) ni les liaisons contractées par les atomes d'hydrogène - on représente uniquement les liaisons carbone - carbone, les groupes (p.ex. OH) et les liaisons avec ces groupes.
Pour plus de détails, consulter la marche à suivre correspondante.
formule ionique :La formule ionique n'indique que le rapport des différents ions dans le composé, étant donné que le nombre d'ions dans le réseau ionique n'est pas déterminé.
formule moléculaire :La formule moléculaire indique la composition exacte d'une molécule, étant donné qu'une molécule est une entité délimitée.
formule semi-développée :La formule semi-développée est une simplification de la formule développée : le plus souvent on ne représente pas les liaisons contractées avec l'hydrogène ou un halogène.
En fonction des propriétés de la molécule qu'on veut mettre en évidence, d'autres façons de regrouper les atomes sont employées.
Pour plus de détails, consulter la marche à suivre correspondante.
formule spatiale :La formule spatiale est une représentation de la structure tridimensionnelle de la molécule dans le plan : les liaisons dans le plan sont représentées par un trait plan ( - ) , les liaisons dirigées vers l'avant par un triangle s'épaississant en direction de l'observateur () et celles dirigées vers l'arrière par des traits interrompus (
).
Pour plus de détails, consulter la marche à suivre correspondante.gaz rare :Les gaz rares sont les éléments de la famille VIII de la classification périodique des éléments : hélium, néon, argon, krypton, xénon, radon.
groupement :On appelle groupement (ou radical), une association d'atomes qui est susceptible de se retrouver en bloc après une réaction chimique. Un tel groupement a une valence et peut s'associer à d'autres atomes ou d'autres groupements.
(voir aussi la liste des valences des éléments et groupements importants)halogène :Les halogènes sont les éléments de la famille VII de la classification périodique des éléments : fluor, chlore, brome, iode, astate.
halogénure d'alkyle :On appelle halogénures d'alkyle les dérivés des alcanes dans lesquels des atomes d'hydrogène sont remplacés par des atomes d'un halogène.
Les noms des halogénures d'alkyle commencent par le préfixe correspondant à l'halogène : chloro-, bromo-, fluoro-, iodo-, précédé le cas échéant par le préfixe multiplicatif. Ils sont obtenus à partir des noms de la série homologue des n-alcanes.
hydracide :Les hydracides sont des acides minéraux ne renfermant pas l'élément oxygène : le reste d'acide est un élément non-métallique ou un groupement non oxygéné.
Le nom des hydracides commence par acide suivi du nom de l'anion correspondant au reste d'acide dans lequel la terminaison «-ure» est remplacée par «-hydrique».
hydrocarbure :Un hydrocarbure est un composé constitué essentiellement de carbone et d'hydrogène.
hydrocarbure insaturé :Un hydrocarbure insaturé renferme au moins une liaison multiple (double ou triple) entre deux atomes de carbone. Le nombre d'atomes d'hydrogène ne correspond pas au nombre maximal d'atomes d'hydrogène, étant donné que des électrons de valence des atomes de carbone sont impliqués dans les liaisons multiples et ne sont plus disponibles pour former des liaisons avec des atomes d'hydrogène.
Les noms des hydrocarbures insaturés ont la terminaison -ène pour des composés à liaisons doubles et -yne pour des composés à liaisons triples : on fait la distinction entre hydrocarbures insaturés aliphatiques à liaisons doubles ou alcènes, hydrocarbures insaturés cycliques à liaisons doubles ou cyclènes et hydrocarbures insaturés aliphatiques à liaisons triples ou alcynes.
hydrocarbure saturé :Un hydrocarbure saturé ne renferme que des liaisons covalentes simples C-C. Le nombre d'atomes d'hydrogène correspond au nombre maximal possible.
Les noms des hydrocarbures saturés ont tous la terminaison -ane : on fait la distinction entre hydrocarbures saturés aliphatiques ou alcanes et hydrocarbures saturés cycliques ou cyclanes.
«hydrogène acide» :Les molécules d'acide renferment toutes l'élément hydrogène lié à un reste d'acide : ces atomes d'hydrogène, qui en solution aqueuse peuvent quitter la molécule sous forme d'ions H+ sont appelés «hydrogènes acides».
Remarque : Les acides carboxyliques renferment beaucoup d'atomes d'hydrogène appartenant au reste d'acide qui ne forment pas d'ions en solution aqueuse mais restent liés par liaison covalente à la chaîne carbonée du reste d'acide : pour les acides organiques, seuls les atomes d'hydrogène des groupementssont des «hydrogènes acides».
hydroxyde :Un hydroxyde est un composé ionique renfermant l'ion OH-. La dissolution dans l'eau des hydroxydes solubles produit des solutions basiques.
hygroscopique :Un corps hygroscopique absorbe l'humidité de l'air.indicateur coloré :On fait la distinction entre indicateurs colorés acide-base, qui sont des substances organiques dont la couleur change avec le caractère acide ou basique du milieu, et indicateurs colorés d'oxydo-réduction, qui sont des substances organiques dont la couleur change avec le caractère oxydant ou réducteur du milieu.
indicateur coloré acide-base :Substance organique dont la couleur change avec le caractère acide ou basique du milieu. (le changement de couleur résulte d'une modification dans la structure de la molécule de colorant)
Un exemple d'un indicateur coloré acide-base est la phénolphthaléine qui est incolore en milieu acide ainsi qu'en milieu neutre et qui prend une teinte rouge-rose en milieu basique.
indice :L'indice, écrit en bas derrière le symbole d'un élément ou d'un groupement placé entre parenthèses, dans une formule chimique, indique le nombre de fois qu'intervient cet élément ou ce groupement. L'indice 1 ne s'écrit pas.
inorganique ou minéral :Les corps inorganiques sont les composés qui sont attribués à la chimie inorganique.
Pour plus de détails, consulter la marche à suivre permettant de distinguer corps organiques et inorganiques.
ion :Un ion est un atome chargé électriquement. L'apparition de charges s'explique par gain ou perte d'électrons.
Un atome ayant perdu un ou plusieurs électrons est chargé positivement : cation. Un atome ayant capté un ou plusieurs électrons est chargé négativement : anion.
ions spectateurs :Les ions spectateurs sont les ions qui, au cours de la réaction, ne subissent pas de transformation.
isomères :Les isomères sont des composés différents qui ont la même formule brute, mais une structure différente.
isotopes :Un élément peut présenter plusieurs isotopes : il s'agit d'atomes ne se distinguant que par le nombre de masse (A) : même nombre (numéro atomique Z) de protons et d'électrons, mais nombre différent de neutrons.
I.U.P.A.C. (international union of pure and applied chemistry) :Organisation internationale qui, entre autres, se prononce sur l'appellation des éléments et composés chimiques. Elle a notamment émis les règles de la nomenclature systématique utilisée en chimie organique.lecture molaire :La lecture molaire d'une équation chimique consiste en l'interprétation de l'équation du point de vue quantitatif :les coefficients stoechiométriques représentent le nombre relatif des atomes ou molécules des différents réactifs et produits intervenant dans une réaction chimique ;
comme 1 mol correspond toujours à 6,022.1023 atomes ou molécules, les coefficients représentent également le nombre relatif des quantités de matière en mol des réactifs et des produits.
liaison covalente :Une liaison covalente entre deux atomes correspond à la mise en commun entre ces deux atomes d'une ou de plusieurs paires d'électrons de valence pour former un ou des doublets de liaison. Un doublet de liaison, mis en commun entre les deux atomes, est considéré comme appartenant à chacun des deux atomes liés. De cette façon chaque atome acquiert une configuration électronique plus stable.
La mise en commun d'1 doublet d'électrons conduit à une liaison simple, celle de 2 doublets à une liaison double et celle de 3 doublets à une liaison triple.
liaison ionique :La liaison ionique correspond à l'ensemble des interactions électrostatiques qui assurent la cohésion des ions dans un réseau ionique.
loi de la conservation de la masse ou loi de Lavoisier :«Rien ne se crée, rien ne se perd, tout se transforme.»
La masse totale des produits formés est égale à la masse totale des réactifs transformés. Lors d'une réaction chimique, le nombre d'atomes de chaque sorte reste constant, les atomes ne font que se regrouper de manière différente.
masse atomique (relative) :La masse atomique relative est la moyenne des masses des différents isotopes constituant l'élément comparée à la référence. Cette référence correspond à 1/12 de la masse de l'isotope le plus répandu du carbone (12C). Comme il s'agit d'une grandeur de comparaison, elle est sans unité.
masse molaire :La masse molaire (M) exprimée en g/mol correspond à la masse d'une mole de substance.
Elle correspond numériquement à la masse atomique relative pour les atomes ou à la masse moléculaire relative pour les molécules.
masse moléculaire (relative) :Masse de la molécule comparée à la référence. Cette référence correspond à 1/12 de la masse de l'isotope le plus répandu du carbone (12C). Comme il s'agit d'une grandeur de comparaison, elle est sans unité.
La masse moléculaire relative (MM) est la somme des masses atomiques relatives de tous les atomes constituant la molécule.
masse volumique :La masse volumiqe (r) d'un corps, exprimée en g/cm3 pour les solides et les liquides et en g/L pour les gaz, est la masse de ce corps par unité de volume :
Elle dépend (surtout dans le cas des gaz) des conditions de température et de pression.
métal :La majeure partie des éléments chimiques appartiennent à la classe des métaux : ces corps se caractérisent par un éclat métallique ainsi qu'une bonne conduction de la chaleur et de l'électricité. Les métaux se situent dans la partie gauche, la partie centrale ainsi que dans une partie de la partie droite du tableau périodique des éléments : voir le détail dans le tableau périodique.
métal noble :Les métaux nobles résistent à l'attaque des ions H+ cédés par les acides. Exemples de métaux nobles : argent, or, platine, ...
métal non noble :Les métaux non nobles sont attaqués par les acides avec dégagement de dihydrogène gazeux et formation d'un sel. Exemples de métaux non nobles : magnésium, zinc, fer, ...
Pour plus de détails, consulter la marche à suivre correspondante.
méthode du chiasme :Cette méthode permet d'établir la formule chimique d'un corps à partir du nom. Elle est décrite dans la marche à suivre.
minéral ou inorganique :Les corps minéraux sont les composés qui sont attribués à la chimie inorganique.
Pour plus de détails, consulter la marche à suivre permettant de distinguer corps organiques et inorganiques.
modèle compact :Dans ce modèle, les atomes sont représentés par des sphères en contact les unes avec les autres. Il montre ainsi l'espace réellement occupé par les atomes, mais ne visualise pas les liaisons entre les atomes.
Pour plus de détails, consulter la marche à suivre correspondante.
modèle de Gillespie ou modèle VSEPR (valence shell electron pair repulsion) :Ce modèle permet de prévoir la géométrie autour des atomes dans une molécule.
Pour plus de détails, consulter la marche à suivre correspondante.
modèle éclaté :Dans ce modèle, les atomes sont représentés par des sphères : celles-ci ne sont pas en contact mais liées par des tiges représentant les doublets de liaison.
Ce modèle visualise les longueurs et les angles des liaisons, mais ne montre pas l'espace réellement occupé par les atomes.
Pour plus de détails, consulter la marche à suivre correspondante.
mole :La mole (mol) est l'unité de quantité de matière. 1 mol est la quantité de matière renfermant 6,022.1023 particules constitutives (atomes, molécules, ...) de cette matière.
La masse d'une mole d'atomes (ou de molécules) (masse molaire en g/mol) correspond numériquement à la masse atomique (ou moléculaire) relative.
molécule :Une molécule est un assemblage d'atomes. Il s'agit de la plus petite partie d'un corps possédant les propriétés de celui-ci.
La molécule est formée d'un nombre déterminé d'atomes : il s'agit d'une entité délimitée et la formule moléculaire indique la composition exacte d'une molécule.n-alcane ou alcane linéaire (n pour normal) :Hydrocarbure saturé aliphatique dont la chaîne carbonée n'est pas ramifiée.
Sa formule générale est de la forme : CnH2n+2.
Les noms des n-alcanes ont tous la terminaison -ane. Consulter les noms de la série homologue des n-alcanes.
neutralisation :Une neutralisation est une réaction entre un acide et une base au cours de laquelle se forment un sel et de l'eau. Les ions qui subissent une transformation au cours d'une telle réaction sont les cations H+ provenant de l'acide et les anions OH- provenant de la base, qui réagissent pour former de l'eau.
Pour plus de détails, consulter la marche à suivre correspondante.
neutre (solution) :Une solution neutre ne présente ni un excès d'ions H+, ni un excès d'ions OH-. Le pH d'une solution neutre est 7.
neutron (n0) :Le neutron est la particule élémentaire sans charge électrique (neutre).
Sa charge est donc 0.
La masse du neutron est presque équivalente à celle du proton et égale à 1,6748 10-27 kg ou 1 (unité de masse relative).
Les neutrons font (comme les protons) partie du noyau atomique : les neutrons et protons sont encore appelés nucléons.
nom / nomenclature systématique :Les noms systématiques en chimie organique résultent des règles internationalement valables (émises par l'I.U.P.A.C.).
Une partie des règles correspondantes peut être consultée dans la marche à suivre.
nombre d'Avogadro :Le nombre d'Avogadro NA = 6,022.1023 particules/mol correspond au nombre de particules (atomes, molécules, ...) renfermées dans une mole.
nombre de masse (A) :Le nombre de masse est le nombre entier qui indique le nombre de nucléons qui composent le noyau de l'atome.
non-métal :Les non-métaux ont des aspects très variés, sont de mauvais conducteurs de la chaleur et de l'électricité (sauf le graphite). Les non-métaux se situent dans une petite partie à droite dans le tableau périodique des éléments : voir le détail dans le tableau périodique.
noyau atomique :Le noyau atomique est situé au centre de l'atome. Bien que son diamètre soit environ 100 000 fois plus petit que celui de l'atome, il contient environ 99,97% de la masse de l'atome.
Le noyau contient les nucléons : protons et neutrons. Il a donc une charge électrique positive, qui ne dépend que du nombre de protons.
nucléons :On appelle nucléons l'ensemble des particules élémentaires qui constituent le noyau de l'atome : protons et neutrons.
numéro atomique (Z) :Le numéro atomique indique le nombre de protons que contient le noyau de l'atome. Un atome étant électriquement neutre, Z correspond également au nombre d'électrons.organique :Les corps organiques sont les composés du carbone. - La chimie organique est la chimie des composés du carbone.
Pour plus de détails concernant aussi des composés du carbone attribués à la chimie inorganique, consulter la marche à suivre permettant de distinguer corps organiques et inorganiques.
oxacide ou oxoacide :Les oxacides sont des acides minéraux renfermant l'élément oxygène : le reste d'acide est un groupement oxygéné.
Le nom des oxacides commence par acide suivi du nom de l'anion correspondant au reste d'acide dans lequel la terminaison «-ate» est remplacée par «-ique», la terminaison «-ite» par «-eux».
oxydant :L'oxydant est le corps qui est donneur d'oxygène au cours d'une réaction d'oxydo-réduction et qui est donc lui-même réduit.
oxydation :L'oxydation d'un corps est la fixation d'oxygène par ce corps.
oxydation / combustion complète :Une oxydation est complète, si l'apport en dioxygène est suffisant : les produits de la combustion complète d'un hydrocarbure sont du dioxyde de carbone et de l'eau.
On voit qu'une combustion est complète au fait que la flamme ne présente pas de brillance.
L'explosion d'un mélange d'un hydrocarbure et de dioxygène (ou d'air) correspond toujours à une oxydation complète.
oxydation / combustion incomplète :Une oxydation est incomplète, si l'apport en dioxygène est insuffisant : les produits de la combustion incomplète d'un hydrocarbure sont du carbone et de l'eau.
On voit qu'une combustion est incomplète à la brillance de la flamme qui provient des particules de carbone chauffées à incandescence.
oxyde :Les oxydes sont les composés inorganiques de l'oxygène. On fait la distinction entre oxydes métalliques, dans lesquels l'oxygène est associé à un métal, et les oxydes non-métalliques, dans lesquels l'oxygène est associé à un non-métal.paraffine :
- Paraffines (parum affinis : qui a peu d'affinité) est un autre nom employé pour les alcanes, à cause de leur relative inertie chimique (au moins à basse température).
- On appelle paraffine également un mélange d'alcanes solides à longues chaînes carbonées.
particules élémentaires :Il s'agit des particules les plus simples constituant l'atome.
Les particules élémentaires sont : les protons p+, les électrons e- et les neutrons n0.
période :Ensemble des éléments constituant une ligne horizontale du tableau périodique des éléments. Les propriétés chimiques des éléments varient de la même façon (périodiquement) dans les différentes périodes.
peroxyde :Les peroxydes sont des composés renfermant le groupement -O-O- ou l'ion O22-.
p.ex. l'eau oxygénée ou peroxyde d'hydrogène : H2O2.
pH :Le pH (potentia Hydrogenii ou potentiel d'hydrogène) est une grandeur numérique caractérisant l'acidité ou la basicité d'une solution aqueuse.
Le pH correspond mathématiquement à l'opposé du logarithme décimal de la concentration molaire en ions H+ ([H+] en mol/L) dans la solution : pH = -log[H+] ou [H+]=10-pH. Ainsi p.ex. une multiplication de la concentration en ions H+ par le facteur 10, entraîne une diminution d'une unité sur l'échelle de pH.
L'échelle de pH s'étend de 0 à 14 :
domaine acide plus l'acide est fort, plus la dissociation en ions est importante, plus la concentration en ions H+est grande et plus le pH est faible domaine neutre domaine basique plus la base est forte, plus la dissociation en ions est importante, plus la concentration en ions OH-est grande et plus le pH est élevé
photochimique (réaction) :Une réaction photochimique s'effectue grâce à un apport d'énergie lumineuse.
produits :Ce sont les corps qui résultent d'une réaction chimique.
proton (p+) :Le proton est la particule élémentaire chargée positivement.
Sa charge est de +1,6 10-19 C : il s'agit de la charge élémentaire positive +1.
La masse du proton est presque équivalente à celle du neutron et égale à 1,6726 10-27 kg ou 1 (unité de masse relative).
Les protons font (comme les neutrons) partie du noyau atomique : les neutrons et protons sont encore appelés nucléons.
proton :Un ion H+ se forme à partir d'un atome d'hydrogène (1 p+, 1 e-, 0 n0) par perte d'un électron : le cation H+ (1 p+, 0 e-, 0 n0) correspond donc à un proton.quantité de matière :La quantité de matière (n) exprimée en mol sert d'unité de compte pour exprimer le nombre d'entités élémentaires (atomes, molécules, ...) dans un échantillon.
Le nombre de particules (atomes, molécules, ...) dans une mole (NA = 6,022.1023 particules/mol) permet de déterminer le nombre de particules (N) dans l'échantillon :N(particules) = n(mol) . NA(particules/mol)
La masse d'une mole de particules (atomes, molécules, ...) (masse molaire M en g/mol) permet de déterminer la masse (m en g) de l'échantillon :m(g) = n(mol) . M(g/mol)
Le volume d'une mole de particules (atomes, molécules, ...) (volume molaire Vm en L/mol) permet de déterminer le volume (V en L) de l'échantillon :V(L) = n(mol) . Vm(L/mol)
ramification :Chaîne carbonée dont au moins l'un des atomes de carbone est lié à plus de deux atomes de carbone voisins.
Les noms des ramifications se terminent en -yle : consulter les noms des principales ramifications
ramifié :Une chaîne carbonée est ramifiée, si au moins l'un de ses atomes de carbone est lié à plus de deux atomes de carbone voisins.
réactifs :Ce sont les corps qui entrent dans une réaction chimique.
réactif en excès :Si dans une réaction interviennent plusieurs réactifs, ceux-ci ne sont pas forcément présents dans les proportions molaires indiquées par les coefficients stoechiométriques de l'équation (proportions stoechiométriques).
Le ou les réactifs disponibles en quantité supérieure à la quantité nécessaire calculée en fonction de la quantité des autres réactifs, sont appelés réactifs en excès. Un réactif en excès n'est pas entièrement consommé au cours de la réaction.
réactif limitant :Si dans une réaction interviennent plusieurs réactifs, ceux-ci ne sont pas forcément présents dans les proportions molaires indiquées par les coefficients stoechiométriques de l'équation (proportions stoechiométriques).
Le réactif disponible en quantité inférieure à la quantité nécessaire calculée en fonction de la quantité de chacun des autres réactifs, est appelé réactif limitant. Le réactif limitant est entièrement consommé au cours de la réaction et limite la quantité de produit qui peut être formée.
réaction d'addition :Au cours d'une réaction d'addition, une liaison multiple se simplifie par fixation d'atomes (ou de groupements d'atomes) supplémentaires.
L'addition d'un halogène sur un alcène ou un alcyne est l'exemple d'une réaction d'addition : des atomes d'halogène se lient aux atomes de carbone des liaisons multiples en utilisant les électrons engagés dans les liaisons multiples : celles-ci se simplifient.
réaction d'oxydo-réduction ou réaction redox :Au cours d'une réaction d'oxydo-réduction, ont lieu simultanément une oxydation et une réduction.
réaction de substitution :Au cours d'une réaction de substitution, un atome (ou un groupement) dans une molécule est remplacé par un autre atome (ou groupement).
L'halogénation photochimique est l'exemple d'une réaction de substitution : des atomes d'hydrogène de la chaîne carbonée sont remplacés par des atomes d'halogènes.
réaction photochimique :Une réaction photochimique s'effectue grâce à un apport d'énergie lumineuse.
réducteur :Le réducteur est le corps qui est accepteur d'oxygène au cours d'une réaction d'oxydo-réduction et qui est donc lui-même oxydé.
réduction :La réduction d'un corps est la perte d'oxygène par ce corps.
règle de l'octet :Lors de réactions chimiques, les atomes qui n’ont pas la configuration électronique stable des gaz rares, s'unissent pour obtenir la configuration en octet du gaz rare le plus proche dans le TPE (8 e- sur la dernière couche).
Deux modes de réaction sont possibles :
- transfert d'électrons d'un atome à l'autre avec formation d'ions : liaison ionique
- mise en commun d'électrons entre deux atomes : liaison covalente.
représentation de molécules :Les différentes façons de représenter des molécules organiques sont présentées dans la marche à suivre correspondante.
réseau ionique :Le réseau ionique correspond à l'assemblage régulier et ordonné des ions dans l'espace. Le nombre d'ions dans le réseau ionique n'est pas déterminé, mais le réseau est globalement électriquement neutre.reste d'acide :Les molécules d'acide renferment toutes un ou plusieurs atomes d'«hydrogène acide» liés à un reste d'acide : le reste d'acide peut être un non-métal ou un groupement non oxygéné dans le cas d'un hydracide et un groupement oxygéné dans le cas d'un oxacide. Dans le cas d'un acide carboxylique, le reste d'acide comprend la chaîne carbonée ainsi que la partie COO du groupement caractéristique des acides carboxyliques.
sel :Les sels sont des composés ioniques constitués pour la plupart d'un cation métallique et d'un anion non-métallique (il peut s'agir d'un groupement non-métallique chargé). Les sels forment des réseaux ioniques : comme le nombre d'ions dans le réseau ionique n'est pas déterminé, la formule ionique n'indique que le rapport des différents ions dans le composé.
série homologue :Les différents termes d'une série homologue (p.ex. celle des n-alcanes) diffèrent les uns des autres seulement par le nombre de groupesdans la chaîne carbonée. Consulter les noms de la série homologue des n-alcanes.
soluté :Un soluté est un corps (solide, liquide ou gazeux) dissous dans un solvant.
solution :Une solution est un mélange homogène formé par un soluté et un solvant.
solution aqueuseUne solution aqueuse est une solution pour laquelle le solvant est l'eau.
solution saturée :À l'exception de certains liquides à miscibilité illimitée, un solvant ne peut dissoudre, à une température donnée, qu'une quantité limitée de soluté : une solution saturée renferme la quantité maximale de soluté pouvant être dissous.
solvant :Un solvant est un corps, le plus souvent liquide, dans lequel est dissous un soluté.
stoechiométrie : (du grec "stoekheion" (élément) et "metrie" (mesure))La stoechiométrie est l'étude des proportions suivant lesquelles les réactifs et les produits interviennent dans une réaction chimique.
Ces proportions se laissent déterminer à partir des coefficients stoechiométriques de l'équation équilibrée.
substitution (réaction de):Au cours d'une réaction de substitution, un atome (ou un groupement) dans une molécule est remplacé par un autre atome (ou groupement).
L'halogénation photochimique est l'exemple d'une réaction de substitution : des atomes d'hydrogène de la chaîne carbonée sont remplacés par des atomes d'halogènes.
symbole :Lettre ou couple de lettres représentant un élément chimique ou 1 atome de cet élément. La première lettre est toujours écrite en majuscule, la deuxième en minuscule.
Pour les symboles et noms des éléments les plus importants, consulter la liste des éléments importants.
symbole de Lewis :Dans le symbole de Lewis on ne représente pas les électrons des couches internes, mais uniquement les électrons de valence. Ces électrons sont symbolisés par des points disposés dans quatre régions autour du symbole de l'élément. Pour les atomes possédant entre 1 et 4 électrons de valence, on place des points isolés (électrons célibataires) dans les différentes régions autour du symbole ; si l'atome possède plus de 4 électrons de valence, les électrons se groupent en paires (doublets électroniques) représentés par deux points ou une barre.
 tableau périodique :Tableau des éléments chimiques disposés en lignes (appelées périodes) et en colonnes (appelées groupes ou familles). Ces dernières regroupent des éléments dont les propriétés chimiques présentent des analogies. Le premier tableau périodique fut imaginé par Mendeleev en 1869.
tableau périodique :Tableau des éléments chimiques disposés en lignes (appelées périodes) et en colonnes (appelées groupes ou familles). Ces dernières regroupent des éléments dont les propriétés chimiques présentent des analogies. Le premier tableau périodique fut imaginé par Mendeleev en 1869.
(voir aussi le tableau périodique ou le tableau périodique ONLINE)
tétraèdre :Un tétraèdre est un polyèdre régulier à quatre faces triangulaires.
unité de masse relative :Il s'agit d'une unité de comparaison : les masses des particules élémentaires, mais aussi celles des atomes et des molécules sont comparées à une référence. Cette référence correspond à 1/12 de la masse de l'isotope le plus répandu du carbone.valence :La valence d'un élément correspond au nombre de liaisons que cet élément peut établir avec d'autres atomes. La valence de l'hydrogène est 1.volume molaire :
(voir aussi la liste des valences des éléments et groupements importants)Le volume molaire d'un gaz (Vm) exprimé en L/mol est le volume occupé par une mole de ce gaz. À des conditions données de température et de pression, tous les gaz ont le même volume molaire :
- aux conditions normales de température et de pression (c.n.t.p.: T=0°C et p=1,013.105 Pa) le volume molaire d'un gaz vaut :
Vm = 22,4 L/mol- à 20° C et sous pression normale : Vm = 24 L/mol.