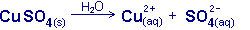Pour déterminer la charge d'un ion à partir du TPE
ou
pour établir les équations traduisant la formation d'un composé ionique
à partir d'un métal et d'un non-métal :
- écrire les symboles de Lewis des différents atomes
- écrire l'équation de perte d'électrons par l'atome métallique :
par perte d'un ou de plusieurs électrons, les atomes métalliques peuvent acquérir la configuration électronique du gaz rare qui les précède dans le TPE
p.ex. le potassium qui possède 1 e- de plus que l'argon, cède cet e- pour former un cation et acquiert ainsi la configuration électronique en octet de l'argon :- écrire l'équation de gain d'électrons par l'atome non-métallique :
par gain d'un ou de plusieurs électrons, les atomes non-métalliques peuvent acquérir la configuration électronique du gaz rare qui les suit dans le TPE
p.ex. l'azote qui possède 3 e- de moins que le néon, capte 3 e- pour former un anion et acquiert ainsi la configuration électronique en octet du néon :- écrire l'équation de transfert d'électrons de l'atome métallique vers l'atome non-métallique :
p.ex. dans la réaction entre le potassium et l'azote,
chaque atome de potassium cède 1 électron et chaque atome d'azote capte 3 e- :
pour assurer ce transfert d'électrons il faut donc 3 fois plus d'atomes de potassium que d'atomes d'azote :
Pour établir la formule d'un composé ionique :
- identifier les différents ions présents dans le composé :
- la charge des ions monoatomiques peut être déterminée directement à partir du TPE (voir plus haut) ou, le cas échéant, de la valence indiquée dans le nom du composé (la charge d'un ion correspond en effet numériquement à la valence de l'élément)
p.ex. charge de l'ion bromure : Br- charge de l'ion fer dans le chlorure de fer(III) : Fe3+
- la charge d'un ion polyatomique (groupement d'atomes) correspond à la valence du groupement : tous les ions des groupements (à l'exception du groupement ammonium) portent une charge négative (voir la liste des charges des groupements)
- établir la formule du composé ionique :
le rapport entre cations et anions doit être tel que le réseau ionique soit globalement électriquement neutre
p.ex. bromure de cuivre(II) : ions Cu2+ et ions Br- dans le rapport 1:2 ce qui conduit à la formule Cu2+(Br-)2 ou CuBr2
Pour établir l'équation de dissolution dans l'eau d'un composé ionique avec les états d'agrégation :
- identifier les différents ions présents dans le composé (voir plus haut)
- montrer par une équation, la destruction dans l'eau du réseau ionique solide (s) en ions hydratés (aq)
p.ex. dissolution du sulfate de cuivre(II) dans l'eau :