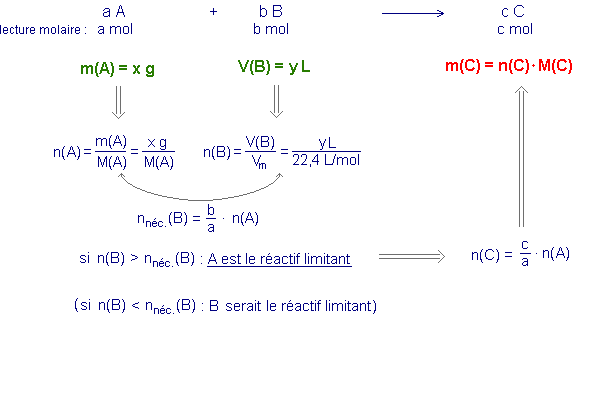
Dans les problèmes avec réactif limitant, les quantités de plusieurs réactifs sont indiquées.
Le plus souvent les réactifs ne sont pas présents dans les proportions indiquées par les coefficients stoechiométriques de l'équation (proportions stoechiométriques). Il faut alors déterminer le réactif qui est en défaut et qui sera ainsi entièrement consommé (réactif limitant). Comme c'est ce réactif qui limitera la quantité de produit formée, tous les calculs concernant les produits formés se baseront sur la quantité de réactif limitant.
Méthode de résolution :
- établir l'équation de la réaction étudiée et éventuellement la lecture molaire
Consulter la marche à suivre du chapitre correspondant.
- convertir en moles les quantités (masse, volume gazeux, volume d'une solution de concentration connue, ...) données
Consulter les marches à suivre (masse, volume gazeux, solution) des chapitres correspondants.
- déterminer à l'aide des coefficients stoechiométriques de l'équation et de la quantité des autres réactifs la quantité de matière nécessaire de chaque réactif, afin d'identifier le réactif limitant
- déterminer à l'aide des coefficients stoechiométriques de l'équation et de la quantité du réactif limitant la quantité demandée en moles
- convertir cette quantité de matière en la grandeur (masse, volume gazeux, volume d'une solution de concentration connue, concentration d'une solution si le volume est connu, ...) demandée.
exemple :
Au cours de la réaction entre un corps A et un corps B il se forme un corps C.
Quelle masse de C obtient-on à partir de x g de A et y L du gaz B? (aux c.n.t.p.)