Consulter aussi la liste des mots-clés.
Les différentes représentations des molécules organiques -
Marche à suivre
-
modèle compact :
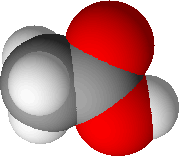
Dans ce modèle (le plus proche de la réalité) les atomes sont représentés par des sphères en contact les unes avec les autres - le code couleur le plus souvent utilisé est : C en noir ; H en blanc ; O en rouge ; N en bleu ; Cl en vert ; S en jaune.
Ce modèle montre l'espace réellement occupé par les atomes, mais ne visualise pas les liaisons entre les atomes.
-
modèle éclaté :
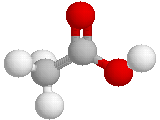
Dans ce modèle les atomes sont également représentés par des sphères : celles-ci ne sont pourtant pas en contact mais liées par des tiges représentant les doublets de liaison - le code couleur le plus souvent utilisé est : C en noir ; H en blanc ; O en rouge ; N en bleu ; Cl en vert ; S en jaune. La longueur des tiges est proportionnelle à la distance entre les noyaux des atomes liés.
Ce modèle visualise les longueurs et les angles des liaisons, mais ne montre pas l'espace réellement occupé par les atomes.
-
formule brute :
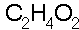
La formule brute renseigne sur la nature et le nombre des atomes qui composent une molécule.
Des indices placés en bas à droite des symboles et groupes d'atomes indiquent la fréquence avec laquelle ils interviennent.
-
formule développée :
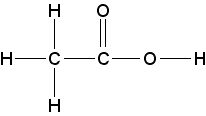
La formule développée renseigne sur l'enchaînement des atomes qui composent une molécule - les symboles de tous les atomes ainsi que toutes les liaisons sont indiqués.
(Généralement les liaisons entre atomes sont représentées à un angle de 90°)
-
formule semi-développée :

La formule semi-développée est une simplification de la formule développée : le plus souvent on ne représente pas les liaisons contractées avec l'hydrogène ou un halogène.
(En fonction des propriétés de la molécule qu'on veut mettre en évidence, d'autres façons de regrouper les atomes sont employées.
Ainsi par exemple dans le cas de la molécule représentée ci-dessus, une autre formule semi-développée moins détaillée serait :
CH3-COOH.
D'autre part, si on s'intéresse davantage au groupe -COOH, on peut écrire de façon développée cette partie de la molécule et la formule semi-développée devient : 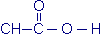 .)
.)
(Généralement les liaisons entre atomes sont représentées à 90°)
-
formule en bâtonnets ou représentation stylisée :

La formule en bâtonnets est une simplification de la formule semi-développée : on n'écrit pas les symboles des atomes de carbone et d'hydrogène (liés à un atome de carbone) ni les liaisons contractées par les atomes d'hydrogène - on représente uniquement les liaisons
carbone - carbone, les groupes (p.ex. ici OH) et les
liaisons avec ces groupes.
-
formule spatiale :
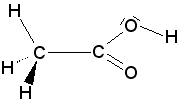
La formule spatiale est une représentation de la structure tridimensionnelle de la molécule dans le plan : les liaisons dans le plan sont représentées par un trait plan ( - )
les liaisons dirigées vers l'avant par un triangle s'épaississant en direction de l'observateur (  )
)
celles dirigées vers l'arrière par des traits interrompus (  ).
).
Afin de mieux rendre compte de la géométrie, les doublets libres sont souvent représentés autour des atomes centraux.
L'orientation des liaisons dans une molécule peut être prévue à l'aide du modèle de Gillespie :
- établir la formule de Lewis
- déterminer la figure de répartition des groupes d'électrons autour de l'atome central :
- sont comptés comme 1 groupe d'électrons : la paire d'électrons d'une liaison simple, les 2 ou 3 paires d'électrons d'une liaison multiple, un doublet libre
- 2 groupes d'électrons autour de l'atome central se situent sur une droite :

3 groupes d'électrons autour de l'atome central se situent aux sommets d'un triangle : 
4 groupes d'électrons autour de l'atome central se situent aux sommets d'un tétraèdre : 
- déterminer la géométrie autour de l'atome central :
- si l'atome central ne porte pas de doublet libre, la géométrie correspond à celle de la figure de répartition :
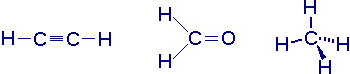
- si l'atome central porte un ou plusieurs doublets libres, la géométrie découle de la figure de répartition comme suit :
figure de répartition triangulaire avec un doublet libre :
géométrie coudée : 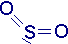
figure de répartition tétraédrique avec un doublet libre :
géométrie pyramidale : 
figure de répartition tétraédrique avec deux doublets libres :
géométrie coudée : 
.)
)
).
