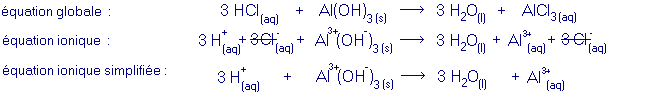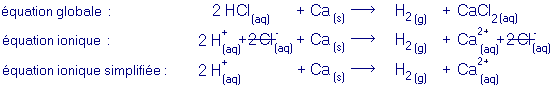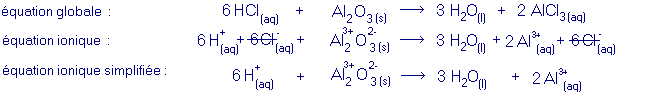Pour les calculs stoechiométriques, consulter la marche à suivre correspondante.
Pour les noms et formules des acides minéraux, consulter la marche à suivre correspondante.
Établir les équations, équations ioniques et équations ioniques simplifiées
pour les réactions caractéristiques des acides -
Marche à suivre
réaction entre un acide et une base (réaction de neutralisation) :
- équation générale :
Une neutralisation est une réaction entre un acide et une base au cours de laquelle se forment un sel et de l'eau. Les ions qui subissent une transformation au cours d'une telle réaction sont les cations H+ provenant de l'acide et les anions OH- provenant de la base, qui réagissent pour former de l'eau :équation générale :
acide + base ® sel + eau- équation ionique :
réactifs :
- En solution aqueuse, un acide fort se dissocie en cations H+ et en anions du reste d'acide, on écrit, dans l'équation ionique, pour l'acide dissous les différents ions en solution (séparés par le signe +).
(Pour les acides faibles, la dissociation en ions n'est que partielle, mais pour montrer que ce sont les ions H+ qui réagissent, on écrit parfois dans l'équation ionique l'acide comme s'il était dissous dans l'eau.)- Pour les hydroxydes solubles dans l'eau les ions se séparent dans l'eau et on peut également écrire les différents ions (séparés par le signe +).
Pour les hydroxydes insolubles, les ions restent associés dans le réseau ionique et il faut écrire la formule ionique de l'hydroxyde sans séparer les différents ions (pas de signe + entre les ions).
produits :
- La plupart des sels qui résultent d'une réaction de neutralisation sont solubles dans l'eau et on peut écrire les différents ions (séparés par le signe +) ; pour les sels insolubles il faut écrire la formule ionique sans séparer les différents ions (pas de signe + entre les ions).
- L'eau est un composé covalent pour lequel il faut écrire la formule moléculaire.
- équation ionique simplifiée :
Dans l'équation ionique, on peut se rendre compte que certains ions ne sont pas transformés au cours de la réaction (ce qui inclut qu'ils ne font pas partie d'un réseau ionique ni dans un réactif, ni dans un produit) : ces ions sont appelés ions spectateurs.
Les ions spectateurs peuvent être supprimés de l'équation ionique afin de mieux mettre en évidence la réaction qui a lieu. L'équation résultante est appelée équation ionique simplifiée.
exemple d'une réaction de neutralisation :
réaction entre un acide et un métal non noble :
remarque : les métaux nobles résistent à l'attaque des ions H+ cédés par les acides
- équation générale :
Au cours de la réaction entre un acide et un métal non noble il se forme un sel et du dihydrogène gazeux. Au cours d'une telle réaction, ce sont les cations H+ provenant de l'acide et les atomes métalliques qui subissent une transformation :équation générale :
acide + métal non noble ® sel + dihydrogène- équation ionique :
réactifs :
- En solution aqueuse, un acide fort se dissocie en cations H+ et en anions du reste d'acide, on écrit, dans l'équation ionique, pour l'acide dissous les différents ions en solution (séparés par le signe +).
(Pour les acides faibles, la dissociation en ions n'est que partielle, mais pour montrer que ce sont les ions H+ qui réagissent, on écrit parfois dans l'équation ionique l'acide comme s'il était dissous dans l'eau.)- Dans les métaux on trouve des atomes neutres.
produits :
- La plupart des sels qui résultent d'une réaction entre un acide et un métal sont solubles dans l'eau et on peut écrire les différents ions (séparés par le signe +) ; pour les sels insolubles il faut écrire la formule ionique sans séparer les différents ions (pas de signe + entre les ions).
- Le dihydrogène est un composé covalent pour lequel il faut écrire la formule moléculaire.
- équation ionique simplifiée :
Dans l'équation ionique, on peut se rendre compte que certains ions ne sont pas transformés au cours de la réaction (ce qui inclut qu'ils ne font pas partie d'un réseau ionique ni dans un réactif, ni dans un produit) : ces ions sont appelés ions spectateurs.
Les ions spectateurs peuvent être supprimés de l'équation ionique afin de mieux mettre en évidence la réaction qui a lieu. L'équation résultante est appelée équation ionique simplifiée.
exemple d'une réaction entre un acide et un métal :
réaction entre un acide et un oxyde métallique :
- équation générale :
Au cours de la réaction entre un acide et un oxyde métallique il se forme un sel et de l'eau. Les ions qui subissent une transformation au cours d'une telle réaction sont les cations H+ provenant de l'acide et les anions O2- provenant de l'oxyde, qui réagissent pour former de l'eau :équation générale :
acide + oxyde métallique ® sel + eau- équation ionique :
réactifs :
- En solution aqueuse, un acide fort se dissocie en cations H+ et en anions du reste d'acide, on écrit, dans l'équation ionique, pour l'acide dissous les différents ions en solution (séparés par le signe +).
(Pour les acides faibles, la dissociation en ions n'est que partielle, mais pour montrer que ce sont les ions H+ qui réagissent, on écrit parfois dans l'équation ionique l'acide comme s'il était dissous dans l'eau.)- Pour les oxydes métalliques insolubles dans l'eau (les oxydes solubles réagissent avec l'eau pour former un hydroxyde) les ions restent associés dans le réseau ionique et il faut écrire la formule ionique de l'oxyde sans séparer les différents ions (pas de signe + entre les ions).
produits :
- La plupart des sels qui résultent d'une telle réaction sont solubles dans l'eau et on peut écrire les différents ions (séparés par le signe +) ; pour les sels insolubles il faut écrire la formule ionique sans séparer les différents ions (pas de signe + entre les ions).
- L'eau est un composé covalent pour lequel il faut écrire la formule moléculaire.
- équation ionique simplifiée :
Dans l'équation ionique, on peut se rendre compte que certains ions ne sont pas transformés au cours de la réaction (ce qui inclut qu'ils ne font pas partie d'un réseau ionique ni dans un réactif, ni dans un produit) : ces ions sont appelés ions spectateurs.
Les ions spectateurs peuvent être supprimés de l'équation ionique afin de mieux mettre en évidence la réaction qui a lieu. L'équation résultante est appelée équation ionique simplifiée.
exemple d'une réaction entre un acide et un oxyde métallique :
réaction entre un acide et un sel :
- équation générale :
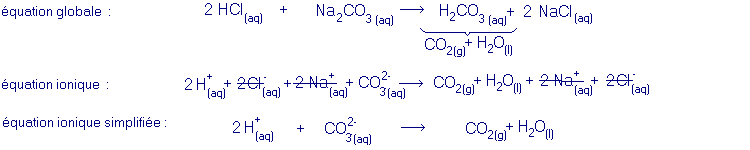
Au cours de la réaction entre un acide fort et un sel d'un acide faible il se forme l'acide faible et un sel de l'acide fort. Les ions qui subissent une transformation au cours d'une telle réaction sont les cations H+ provenant de l'acide et les anions provenant du sel, qui réagissent pour former l'acide faible (présent en majeure partie sous forme non dissociée). Certains acides faibles, comme p.ex. l'acide carbonique, sont très peu stables et se décomposent spontanément, ce dont il faut tenir compte dans les équations.équation générale :
acide fort + sel d'acide faible ® sel de l'acide fort + acide faible- équation ionique :
réactifs :
- Comme en solution aqueuse, un acide fort se dissocie en cations H+ et en anions du reste d'acide, on écrit, dans l'équation ionique, pour l'acide dissous les différents ions en solution (séparés par le signe +).
- Pour les sels d'acide faible solubles dans l'eau, les ions se séparent dans l'eau et on peut également écrire les différents ions (séparés par le signe +).
Pour les sels insolubles, les ions restent associés dans le réseau ionique et il faut écrire la formule ionique du sel sans séparer les différents ions (pas de signe + entre les ions).
produits :
- La plupart des sels qui résultent d'une telle réaction sont solubles dans l'eau et on peut écrire les différents ions (séparés par le signe +) ; pour les sels insolubles il faut écrire la formule ionique sans séparer les différents ions (pas de signe + entre les ions).
- L'acide faible n'est que peu dissocié en solution et est donc un composé covalent pour lequel il faut écrire la formule moléculaire.
- équation ionique simplifiée :
Dans l'équation ionique, on peut se rendre compte que certains ions ne sont pas transformés au cours de la réaction (ce qui inclut qu'ils ne font pas partie d'un réseau ionique ni dans un réactif, ni dans un produit) : ces ions sont appelés ions spectateurs.
Les ions spectateurs peuvent être supprimés de l'équation ionique afin de mieux mettre en évidence la réaction qui a lieu. L'équation résultante est appelée équation ionique simplifiée.
exemple d'une réaction entre un acide fort et un sel d'acide faible :